国家自然科学基金可以帮助研究型临床医生和科学家成长,在成长过程中国自然标书的申请,以及成果的转化,是一个永恒的话题。我们知道,国自然的转化成果类型包括:期刊论文、**、会议论文、奖励、专著。那么工具病毒是如何助力老师们的国自然成果转化呢?为了便于老师们理解工具病毒的功能与应用场景,我从国自然官网上检索出了腺相关病毒[1]、慢病毒[2]、腺病毒[3]助力,国自然成果转化的期刊论文,进行简要解读。
工具病毒的主要功能有助力发现靶点、标记细胞、操控基因、递送基因表达元件等。为了保护国自然主要参与者的权益,在本篇软文中,我只对已经发表出来的期刊论文进行解读,展示工具病毒的应用场景。如果老师们对国自然标书感兴趣,可以去国自然官网检索相关内容。
一、AAV助力国自然研究
本文来源于国自然官网中,血管稳态失衡中的细胞命运转变及调控机制研究。

低密度脂蛋白受体(LDLR)突变是家族性高胆固醇血症(FH)的主要原因之一,FH可诱发动脉粥样硬化,终生患心血管疾病的风险很高。CRISPR/Cas9系统是一种有效的基因编辑工具,可以纠正基因突变,从而改善疾病。具体是怎么操作的呢?
1. LdlrE208X基因敲入点突变小鼠的建立与验证
在LDLR的18个外显子中,绝大多数基因突变发生在第4个外显子中。之前的研究中已证明,FH患者中E207X(G to T的点突变,GAG-TAG),导致了LDLR的无义点突变(Figure 1A)。为了构建Ldlr–/–基因敲入小鼠模型,作者借助CRISPR-Cas9技术在小鼠受精卵中,通过同源定向修复产生一个,相当于人类Ldlr基因的E207X突变(Figure 1C)。为了验证Ldlr–/–模型是否成功建立,作者借助一代基因测序、qPCR、WB和免疫荧光实验,证实Ldlr–/–模型成功建立,可以用于后续实验。
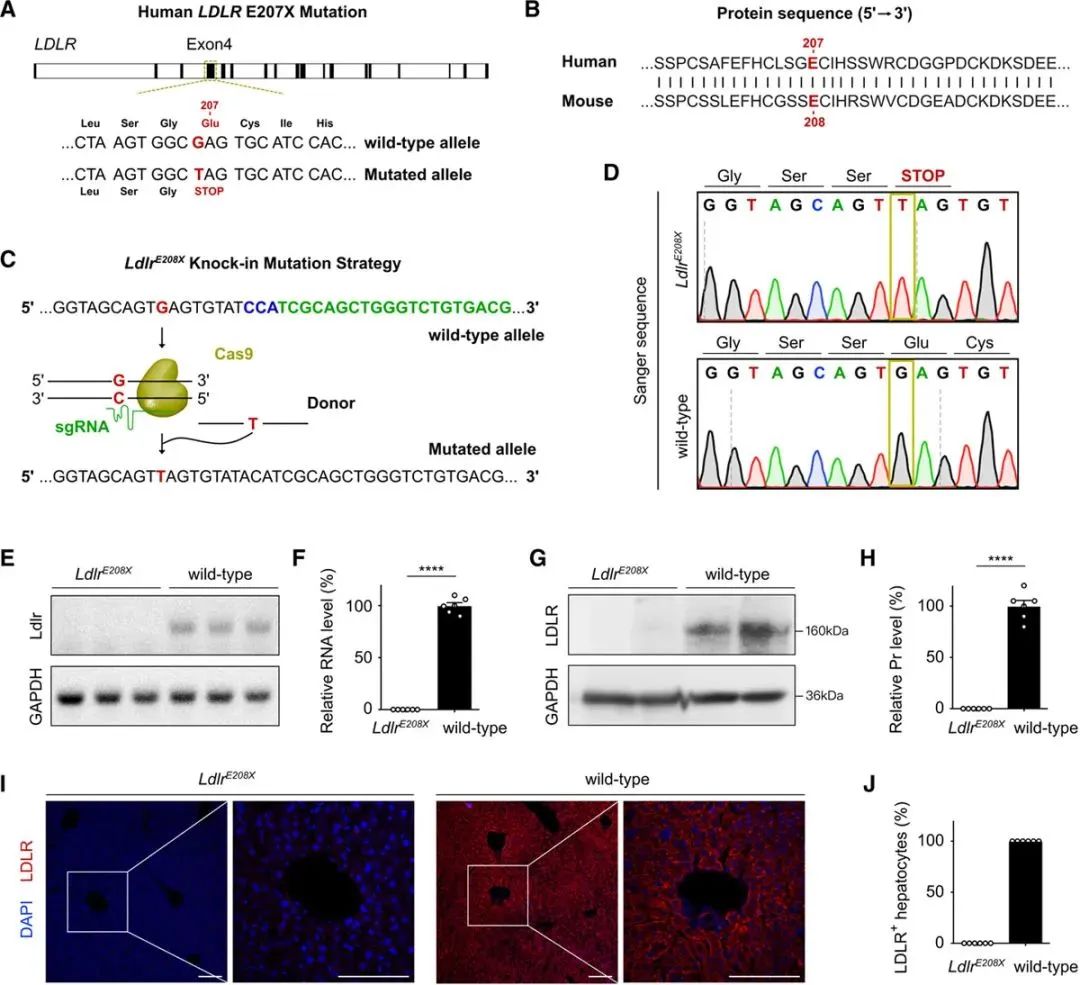
2.高脂饮食方案后LdlrE208X小鼠,出现动脉粥样硬化
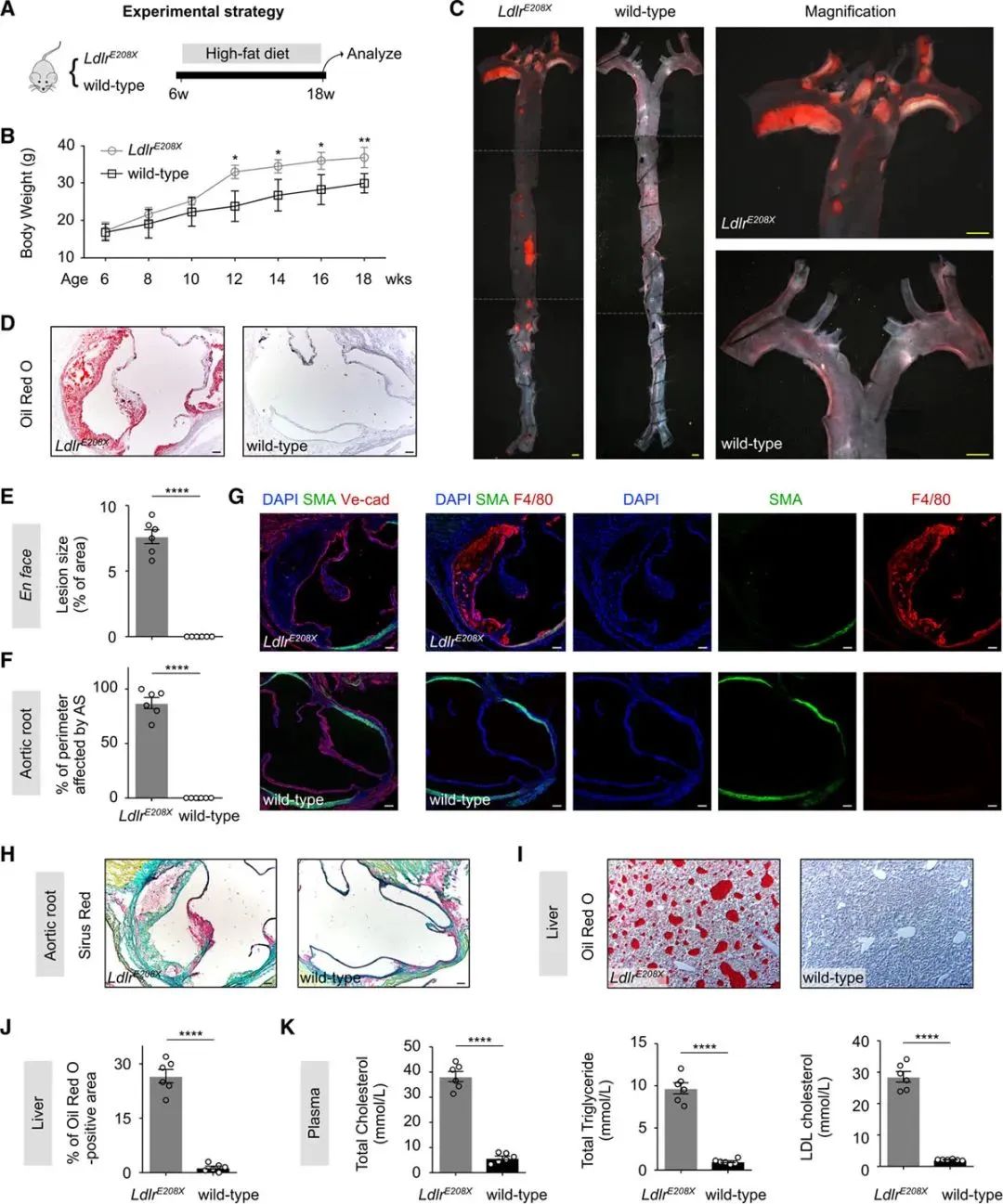
LDLR蛋白在从血清中吸收低密度脂蛋白,从而调节循环系统中的胆固醇水平方面起着至关重要的作用。我们在LdlrE208X雄性小鼠和野生型雄性小鼠6周龄时开始喂食12周的高脂饮食(Figure 2A,2B)。高脂饲料喂养12周后,两组小鼠体重均有所增加,但LdlrE208X小鼠在高脂饲料喂养6周及以后的体重均显著高于野生型对照组。HE染色和油红O染色结果显示:主动脉动脉硬化程度,肝脏中脂质蓄积程度高于对照组(Figure 2C,2E,2I)。免疫荧光结果显示:平滑肌细胞标志物,包括α-平滑肌肌动蛋白(α-SMA)、平滑肌蛋白22α (SM22α)、平滑肌肌球蛋白重链(SM-MHC)和钙钙蛋白,显示这些SMC细胞骨架蛋白在动脉粥样硬化斑块中显著降低甚至丢失,代表着从收缩型到合成型的变化,称为平滑肌细胞表型改变;此外,巨噬细胞(F4/80)进入损伤区(Figure 2G)。血浆中的总胆固醇含量、甘油三酯含量以及LDL-胆固醇含量,均高于对照组(Figure 2K)。这些数据表明:LdlrE208X的病理特点与FH的临床特点高度相似。
3.经过基因治疗的LdlrE208X小鼠,肝脏中LDLR表达水平得到部分恢复
由于AAV血清型8具有高特异性和高效率地转导肝细胞,作者建立了AAV8-CRISPR/Cas9系统来靶向点突变,旨在部分恢复LdlrE208X小鼠肝脏中LDLR的表达(Figure 3A)。作者设计了实验组(将两种AAV的混合物,包括5E+11vg的AAV-sgRNA-Donor和5E+10vg的AAV-Cas9)于对照组(Figure 3B)。为了评估AAV8-CRISPR/Cas9介导的基因编辑的准确性,作者使用了深度测序来分析靶上和靶外位点。在25%的Ldlr等位基因中检测到indels,在治疗组的6.7%的Ldlr等位基因中,观察到HDR介导的T-G突变的纠正(Figure 3C)。为了从多角度评估基因编辑效果,作者借助RT-PCR、qPCR、WB、IF(Figure 3D-3G)证明AAV8-CRISPR/Cas9介导的Ldlr体内基因编辑,可以部分LdlrE208X小鼠肝脏中LDLR的表达。
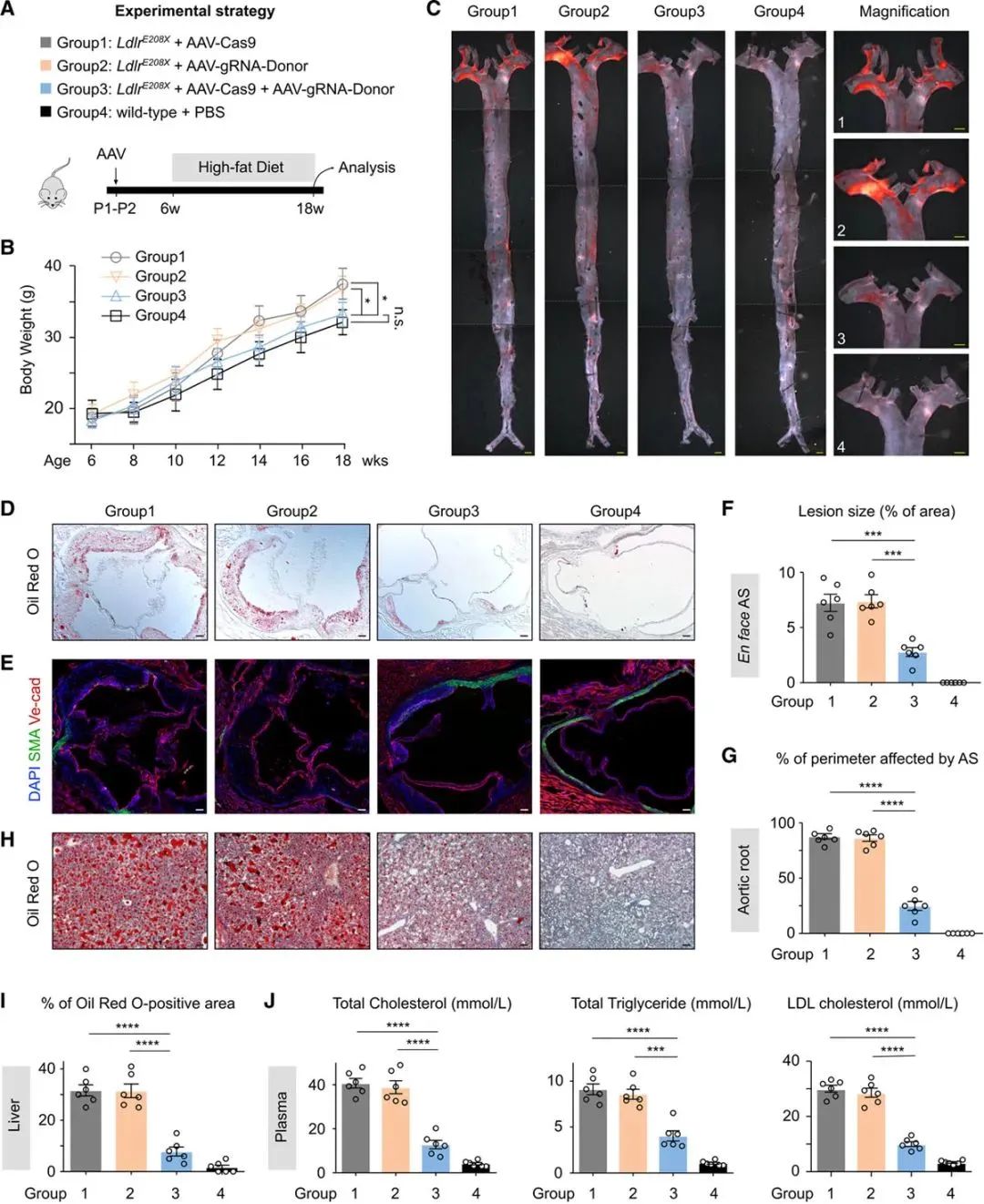
4. AAV-CRISPR/Cas9治疗后LdlrE208X小鼠后,动脉粥样硬化得到改善
为了进一步评估AAV-CRISPR/Cas9介导的基因校正疗法,对人类FH治疗的转化作用。作者分析了各组小鼠,在高脂饮食后的动脉粥样硬化和血浆胆固醇水平。平均而言,各组小鼠体重均有增加,但AAV-CRISPR/Cas9治疗组小鼠的体重,显著低于组1和组2,但与野生对照小鼠没有明显差异(Figure 4A、4B)。紧接着,作者进行了主动脉的油红O染色、SMA、Ve-cad免疫染色,治疗组的动脉硬化板块负担、主动脉中膜的脂质堆积、平滑肌层的破坏明显减轻(Figure 4C、4D、4E)。肝脏和血液系统里的脂质水平检测,实验组也显著优于对照组(Figure 4F-4J)。最终,这些数据证明了,AAV-CRISPR/Cas9在Ldlr突变基因校正中的有效性,以及临床转化的可行性(Figure 5)。
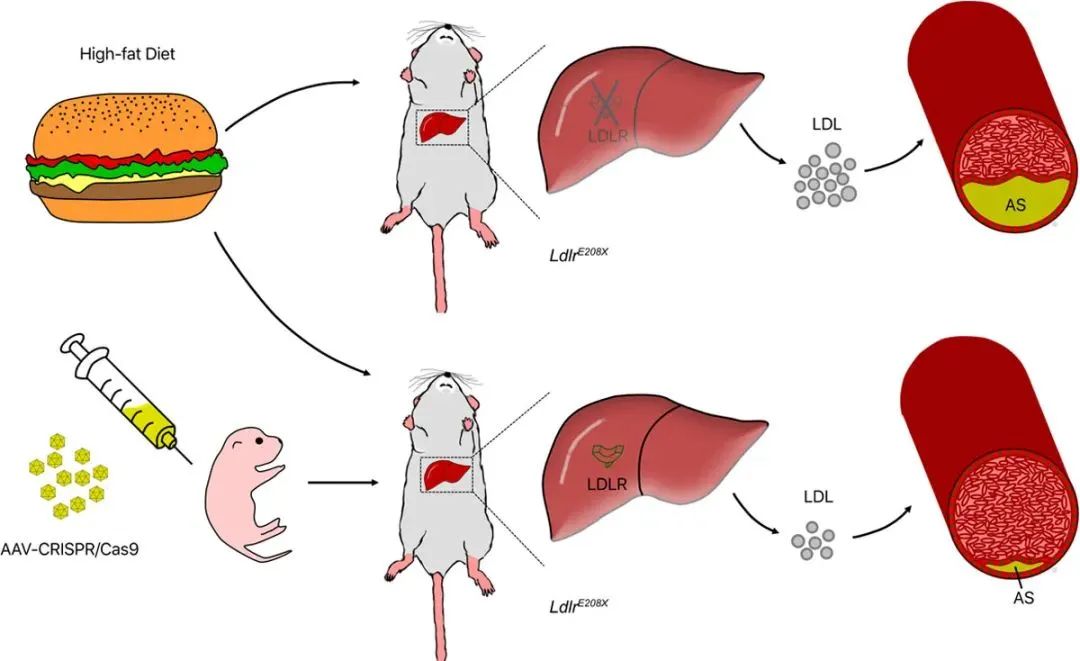
二、慢病毒助力国自然研究
本文来源于国自然官网中,受体酪氨酸激酶对肿瘤靶向治疗耐药性进展过程调控机研究。

靶向KRAS途径是一种有前景但具有挑战性的结肠直肠癌治疗方法。尽管MEK抑制剂在BFAF突变的黑色素瘤中显示出强大的疗效,但由于其内在的代偿信号,MEK抑制剂似乎被结直肠癌细胞所耐受。
多种高通量全基因组筛选方法已被应用于识别导致人类癌症耐药性的关键基因。此前,利用shRNA文库筛选RNA干扰,敲除靶向基因已被广泛应用。然而,基因敲除效率低下和脱靶效应限制了它们的应用。近年来,慢病毒介导的CRISPR-Cas9文库系统在基因组编辑技术上的创新提供了一种新的思路。克服这些限制的另一种方法。它已被用于在体外和体内识别对癌细胞存活、增殖和靶向耐药至关重要的基因。因此,我们进行了全基因组CRISPR/Cas9敲除筛选,以确定关键的致癌基因,克服CRC细胞中的MEKi抗性。进一步,我们进行了MEK和PLK1激酶的联合靶向研究,以研究其在体外和体内对CRC的影响。我们的发现不仅有助于阐明结直肠癌对MEK靶向治疗的原发性耐药机制,而且还为临床治疗提供了一种组合方案。那么,作者是如何证明的呢?
1. RTK途径介导KRAS突变型结肠癌的MEKi耐药性
为了识别与MEKi抗性相关的关键驱动基因,作者选择了直肠癌的肿瘤细胞系,设计了与全基因组CRISPR-Cas9的组合策略,KRAS突变细胞系的敲除文库筛选和转录组学分析(Figure 1A)。为了保持大约500* sgRNA的覆盖率,2E+8的稳定表达Cas9蛋白的细胞,被人GeCKO文库,双载体慢病毒系统感染。通过控制感染MOI接近0.3,严格控制每个细胞的单基因敲除。嘌呤霉素筛选后,细胞分别用DMSO或AZD6244(MEKi)处理7天。
随后,包含sgRNA的基因组DNA,通过PCR扩增和高通量测序。作者假设驱动抗性的基因在AZD6244处理的细胞中被有效转录,因此初步鉴定的TPM值大于10的基因,被确定为自信候选基因。基于这一策略,作者筛出了靶向1846个基因的sgRNAs。基因本体(Gene Ontology, GO)富集分析结果显示,这些基因主要分布在跨膜受体蛋白酪氨酸激酶信号通路(RTK通路)、NF-κB通路、TGF-β通路和外源性凋亡调节通路(Figure 1B)。CRC细胞的转录组分析显示,在MEKi处理后,RTK基因的表达模式显著中断(Figure 1C、1D)。
此外,基因集富集分析(GSEA)也发现,在MEKi处理的CRC细胞中,RTK通路基因的表达显著上调(Figure 1E)。为了进一步证实这一结果,作者对MEKi处理后的RTK通路中的蛋白进行了WB分析,结果显示:EGFR, MET, FAK, STAT3, and AKT的磷酸化水平显著上调。这些数据表明RTK通路在MEKi抗性中起关键作用,后续的实验作者将研究的焦点聚焦在RTK通路上。
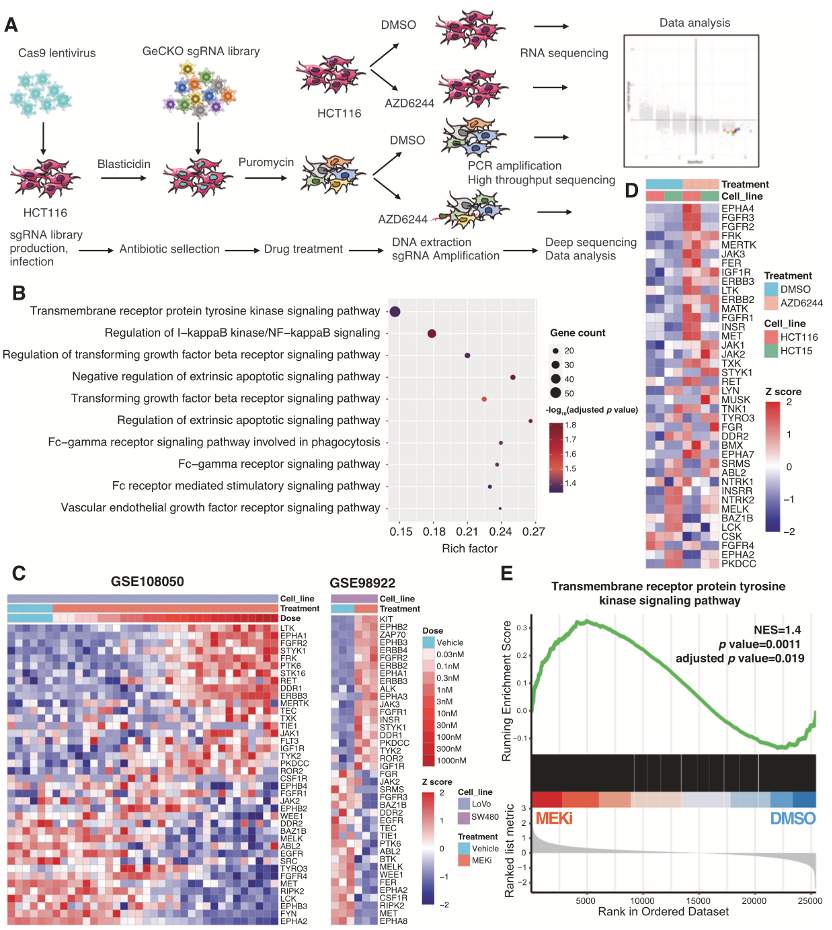
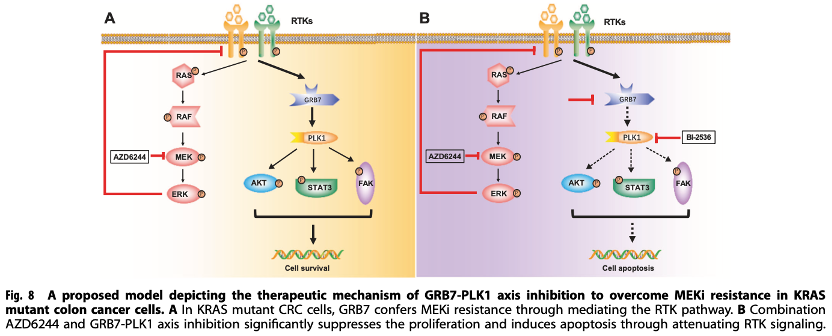
作者通过文库病毒,筛出了本文的研究靶点,又通过生信分析,进一步锁定了RTK-GRB7-PLK1通路,借助高通量测序、组学、免疫荧光、流式分析、药学分析等技术验证后,最终作者得出结论RTK-GRB7-PLK1通路与MEK的联合抑制,为结肠癌患者的治疗提供了一种有前景的策略。在当下这个时代,很多实验室在机制的发现和验证,已经具备了成熟的体系,而文库病毒的出现,加速了发现新靶点的进程,使得工具病毒成为助力老师们科学研究的强有力的工具。
三、腺病毒助力国自然研究
本文来源于国自然官网中,纳米磷酸钙携载药物与肿瘤类器官的相互作用研究。
溶瘤腺病毒(OAs)在癌症病毒基因治疗中的临床研究显示出了巨大的潜力。迄今为止,临床试验表明,OAs的疗效仍然受到肝脏隔离和先前存在的中和抗体的限制,这些中和抗体减少了OAs在肿瘤中的积累[3]。
为此,科学家尝试了很多方法。1.开发新的血清型Ad5.5,尽管特异性极强,工艺繁琐,难以量产;2.通过化学修饰封装病毒,像三甲基-氨丙烷氯盐(DOTAP)、聚乙二醇(PEG)等,这种方法可能导致病毒的毒性增加,因为一些带正电的聚合物可以结合血液中带负电的蛋白质;3.生物矿化是自然生物系统中普遍存在的现象,具有使生物有机体和无机物质结合的显著优势,不仅保留了生物有机体的活性,而且赋予了它们更多的功能生物矿化策略,一般应用于在适度条件下对生物体(包括病毒)的修饰。
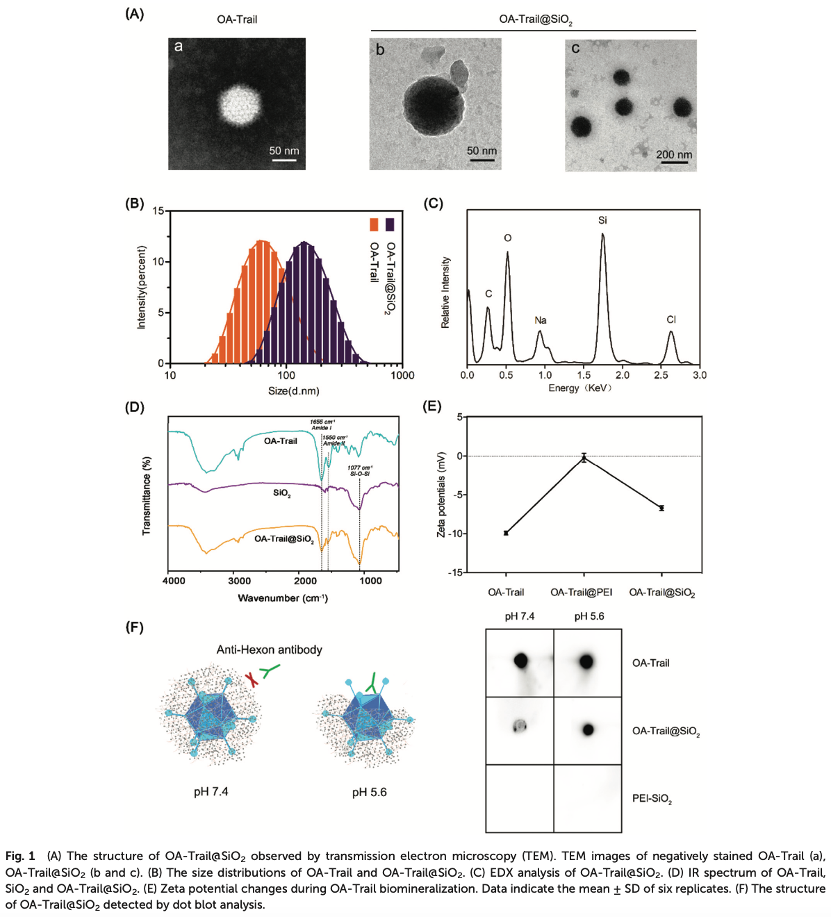
1.OA-Trail@SiO2的合成与表征
病毒表面带负电荷的蛋白质与带正电荷的PEI形成静电吸引,并在病毒表面形成矿化位点(Figure 1A)。经过专业材料学方面的评估(Figure 1BCDE)与斑点杂交试验表明,硅胶外壳可以屏蔽六边形蛋白,并阻止特定抗体对OA-Trail的识别(Figure 1F)。在pH值为7.4的条件下,未处理的OA出现斑痕,但由于OA表面有二氧化硅涂层,在OA@SiO2位置没有斑痕。在pH为5.6的条件下,重新出现了OA@SiO2位置的斑点标记,表明硅胶涂层被降解,OA被重新暴露。此外,降解实验结果还表明,OA@SiO2的二氧化硅涂层被降解,OA恢复正常。
2. OA-Trail@SiO2的体外抗肿瘤作用
感染实验是验证病毒传染性最直观的实验,因此研究了矿化OA-Trail对Hep-G2细胞的细胞病变作用。结果表明,在感染72h时,OA-Trail和OA-Trail@SiO2具有相似的感染能力。用OA-Trail@SiO2处理的Hep-G2细胞变圆并开始脱落,与对照组相比,显示出显著的病理效应(Figure 2A),这表明矿化过程是生物相容性的,几乎不影响病毒的活力和感染性。结果显示,在感染后48小时,两种病毒之间没有差异,因为细胞在48小时已经完成了病毒的分离;然而,在24小时时,OA-Trail@SiO2-treated细胞显示出明显高于原生OA-Trail处理的细胞的病毒浓度(Figure 2B),表明纳米病毒的细胞内吞效率很高。此外,共聚焦显微镜图像还显示,在预感染阶段,“二氧化硅涂层”加速了细胞对病毒的吸收过程(Figure 2C、2D)。

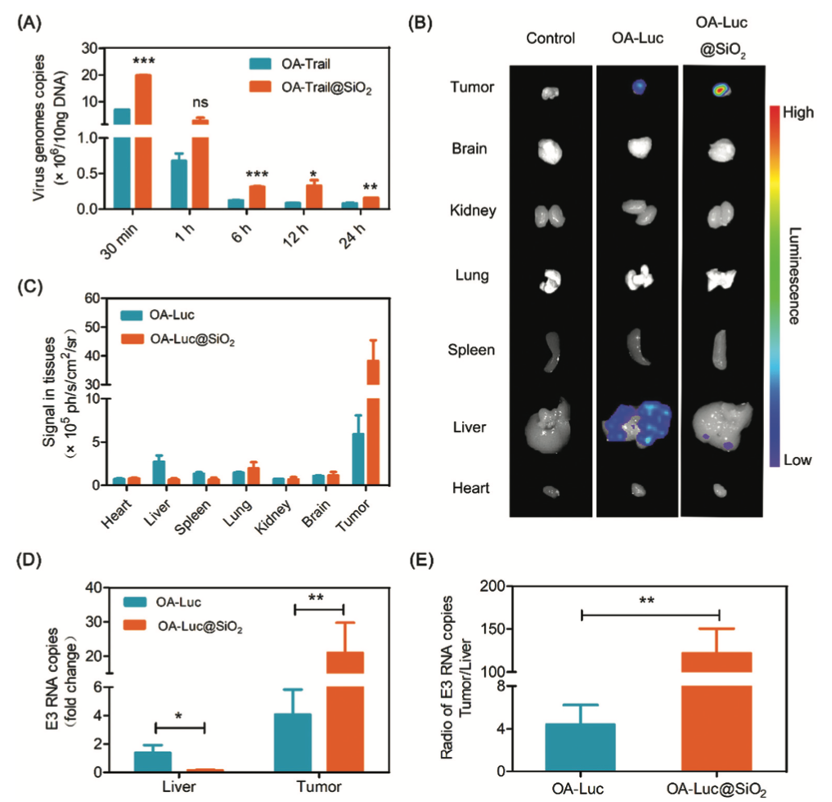
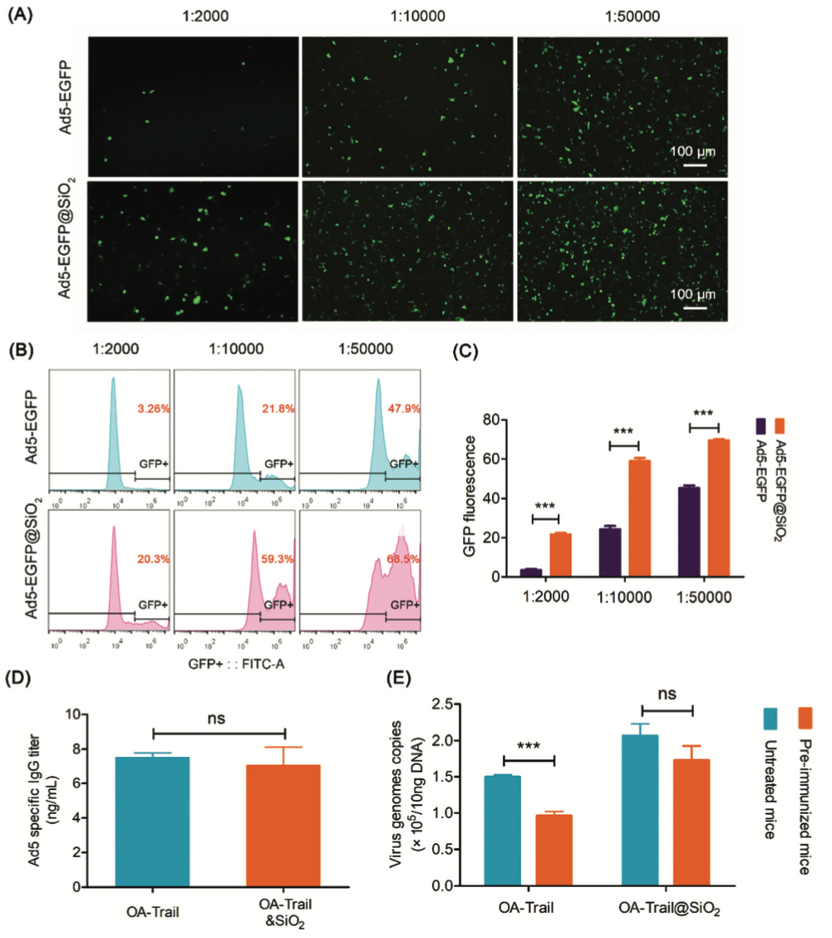
3. OA-Trail@SiO2在体内的生物分布
大多数Ad5菌株会在静脉注射后3分钟内定位于肝脏。因此,为了观察血液中病毒的存在,我们将OA-Trail或合成的OA-Trail@SiO2材料系统地注射到小鼠体内,并采用实时定量PCR (real-time quantitative PCR, qPCR)方法观察结果。正如所料,OA-Trail@SiO2从血液中清除的过程明显慢于OA-Trail(Figure 4A),但在OA-Luc@SiO2治疗组,静脉注射后第2天,肝内荧光信号明显减弱,肿瘤内荧光信号明显高于OA-Luc治疗组(Figure 4B、4C)。这些结果也表明“二氧化硅涂层”对防止病毒向肝有积极作用。接下来,通过qPCR观察肿瘤和肝脏中病毒的存在,肿瘤和肝脏中E3 RNA拷贝的结果与肿瘤和肝脏的荧光成像结果呈现相同的趋势(Figure 4D)。为了表明生物硅化改善了病毒在体内的生物分布,计算了E3 RNA拷贝的肿瘤/肝脏比值,与OA-Luc处理的小鼠相比,该比值在OA-Luc@SiO2治疗的小鼠中增加了约30倍(Figure 4E)。这些结果表明,由于“二氧化硅涂层”的保护作用,系统给药OA@SiO2在体内的生命周期较长,这意味着OA@SiO2的肿瘤积累量高于OA本身。
4. OA-Trail@SiO2显示了逃脱免疫清除的能力
血液中腺病毒特异性的抗体阻碍了OA-Trail在基因治疗中的应用,这种抗体中和降低了病毒的活性和转基因的表达。作者研发了“二氧化硅涂层”是否在中和试验中保护病毒免受抗体识别。荧光显微镜下对Hep-G2细胞的GFP荧光信号分析表明,当中和抗体大量存在时,Ad5增强的绿色荧光蛋白(EGFP)处理的Hep-G2细胞中GFP的表达明显受到阻碍,但Ad5-EGFP@SiO2治疗的Hep-G2细胞中GFP的表达受到抑制。在同样的情况下,细胞仍有较高的GFP表达(图5A)。流式细胞术分析结果还显示,在GFP平均荧光强度水平下,Ad5- EGFP@SiO2治疗的细胞的荧光强度高于Ad5-EGFP处理的细胞(图5B和C)。这些结果表明,“二氧化硅涂层”在体外消除了中和抗体对病毒的识别。
5. OA-Trail@SiO2增强体内抗肿瘤作用
在分析OA-Trail@SiO2静脉给药的生物分布的基础上,进一步在裸鼠Hep-G2移植瘤模型中评估OA-Trail@SiO2的抗肿瘤能力。小鼠每隔一天静脉注射PBS、OA-Trail或OA-Trail@SiO2,当肿瘤体积达到100mm3时,共注射3次(2×1010vps /次)。
阴性对照PBS治疗后,肿瘤平均体积在27天后增长到约1646mm3。然而,与PBS相比,OA-Trail@SiO2治疗显示明显的肿瘤生长抑制(TGI:69.0%)(Figure 6A)。相反,OA-Trail的抗肿瘤作用不明显,TGI值仅为25.8%,但在体外对肿瘤细胞表现出相当大的毒性(Figure 3A)。然后对肿瘤切片进行苏木素和伊红(HE)染色、免疫组化染色和TUNEL分析,研究OA-Trail@SiO2在体内对肿瘤细胞凋亡的诱导作用(Figure 6C)。在OA-Trail@SiO2治疗的肿瘤切片中,OA的hexon蛋白清晰可见,Tr表达高观察治疗期间的情况(Figure 6B)。这些结果表明,静脉注射OA-Trail@SiO2可有效到达肿瘤并表达Trail基因,导致肿瘤细胞凋亡。
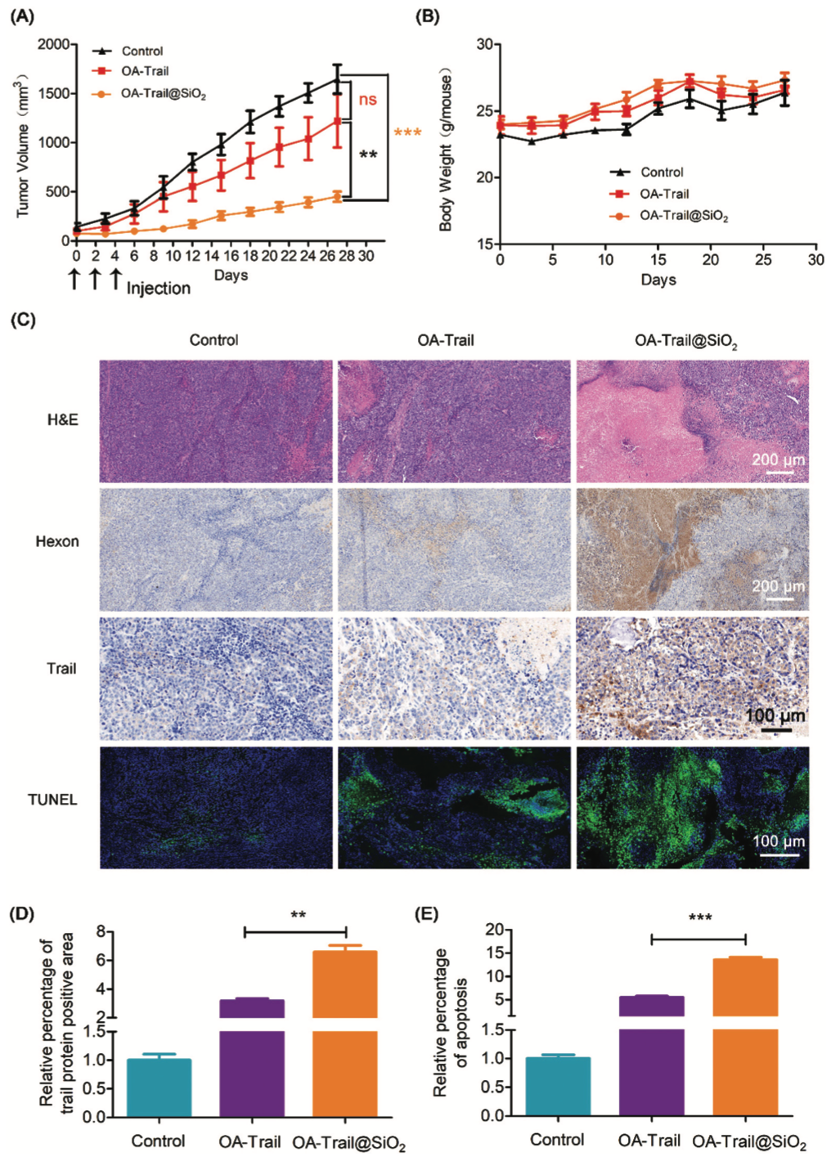
综上所述,利用生物硅化方法,在温和条件下成功构建了OA@SiO2核壳结构。重要的是,该策略改善了全身给药后OA的生物分布,显著降低了肝毒性。此外,合成的OA@SiO2在“二氧化硅涂层”的保护下可以逃脱免疫清除。我们观察到OA@SiO2具有较长的血液循环时间,高效的OA在肿瘤中的积累和体内抗肿瘤作用。这些结果表明,OA@SiO2作为一种新的肿瘤病毒基因治疗策略具有巨大的应用潜力。
小 结
本文通过在国自然官网,检索出3篇由国自然课题,转化而来的科研成果。AAV、LV、Ad助力老师们发表了期刊论文,向科研道路上,迈出了扎实的一步。希望科学家不断研发出的更为高效的工具病毒,为老师们的研究,走出一条星光大道。
【参考文献】
1. Zhao H, Li Y, He L, Pu W, Yu W, Li Y, Wu YT, Xu C, Wei Y, Ding Q, Song BL, Huang H, Zhou B. In Vivo AAV-CRISPR/Cas9-Mediated Gene Editing Ameliorates Atherosclerosis in Familial Hypercholesterolemia. Circulation. 2020 Jan 7;141(1):67-79. doi: 10.1161/CIRCULATIONAHA.119.042476. Epub 2019 Nov 29. PMID: 31779484.
2. Yu C, Luo D, Yu J, Zhang M, Zheng X, Xu G, Wang J, Wang H, Xu Y, Jiang K, Xu J, Ma X, Jing J, Shi H. Genome-wide CRISPR-cas9 knockout screening identifies GRB7 as a driver for MEK inhibitor resistance in KRAS mutant colon cancer. Oncogene. 2022 Jan;41(2):191-203. doi: 10.1038/s41388-021-02077-w. Epub 2021 Oct 30. PMID: 34718347; PMCID: PMC8732282.
3. Kong H , Zhao R , Zhang Q , Iqbal MZ , Lu J , Zhao Q , Luo D , Feng C , Zhang K , Liu X , Kong X . Biosilicified oncolytic adenovirus for cancer viral gene therapy. Biomater Sci. 2020 Oct 7;8(19):5317-5328. doi: 10.1039/d0bm00681e. Epub 2020 Aug 11. PMID: 32779647.
