在工具病毒助力肿瘤研究的话题中,CAR-T病毒占有一席之地,CAR-T全称是嵌合抗原受体T淋巴细胞,是从患者的外周血中分离出T淋巴细胞并进行体外基因改造,大量扩增后,再回输到患者体内,CAR-T能够特异性识别肿瘤抗原,在肿瘤抗原的刺激下,这些输入的CAR-T快速增殖,结合并杀灭肿瘤细胞。
但CAR-T治疗也有不完美地方:造价高昂、适应症少、细胞因子风暴以及免疫力下降导致的感染风险。临床上急需一种高效且安全、可控的载体,扩展治疗肿瘤的手段。今天我为老师们解读一篇文献:Leveraging gene therapy to achieve long-term continuous or controllable expression of biotherapeutics。使用腺相关病毒(AAV)来表达双特异性抗体(CD19×CD3),从而解决了双特异性抗体需要反复多次给药的缺点和CAR-T疗法生产流程繁琐、需要个性化定制的缺点,实现了一次给药,长期稳定表达治疗性双抗,可作为通用型CAR-T 疗法的替代方案。此外,该研究还开发了诱导型版本,利用外显子跳跃技术,可实现按需表达、重复表达。

基因治疗的高速发展,①使替换缺失或有缺陷的基因,产生持续表达的转基因成为前提;②单次剂量注射后,在体内实现持续和一致的血药水平,从而解决潜在的蛋白质药物的波峰和波谷问题;③为了增加基因治疗的可控性,作者开发了TransSkip体系。那么,作者是怎么设计实验的呢?
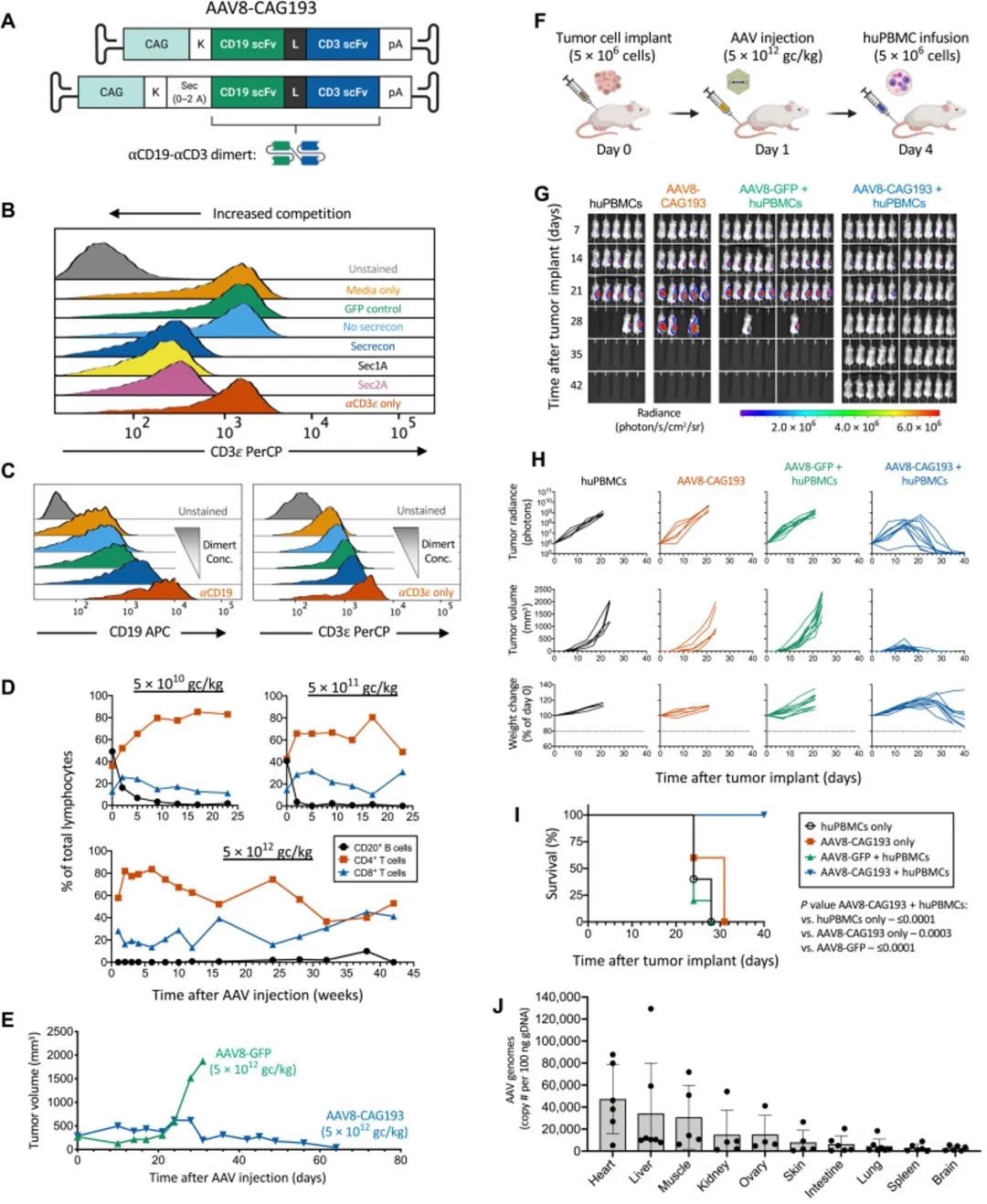
作者首先设计并测试了AAV8载体,启动子选择CAG(1.7kb),用于表达blinatumomab的氨基酸序列[1] (blinatumomab瞬时连接T细胞与靶细胞,促进T细胞活化和靶细胞凋亡,最先进的药物,但半衰期只有2.1h);为了保证蛋白质双特异性抗体(CD19×CD3)高效地分泌到血液中,作者将分泌信号肽构建到外源基因的N端[2]。完成AAV的设计后,作者进行了在体实验:将Raji-Luc/GFP淋巴瘤细胞注入免疫缺陷小鼠,同时静脉输注人外周血单核细胞(Figure 1F),通过评估体内生物荧光、肿瘤大小、动物生存率、AAV的毒性,最终,作者证明单次注射AAV,B细胞持续消融,而T细胞长期保持活跃状态,可以有效消除肿瘤。
在AAV8有效的基础上,作者将强启动子CAG更换为EFS(232bp),因为AAV的包装容量限制在4.7kb以内。在罕见的宿主细胞插入事件中,较弱的启动子也表现出较低的相邻基因激活的基因毒性[3]。同时,作者加入了转录后调节元件(WPRE)这种RNA稳定元件,最大程度弱化启动子对外源基因的表达。此外,AAV的血清型选择rh74,因为人类中先前存在rh74抗体的患病率较低。更换了AAV的血清型和启动子后,作者进一步评估了血清中的CD19-CD3二聚体蛋白水平,与长期表达的关系。实验证明:在至少1年的时间里,蛋白表达水平相对稳定,动物没有表现出与对照组动物相似的正常体重增加的毒性迹象。
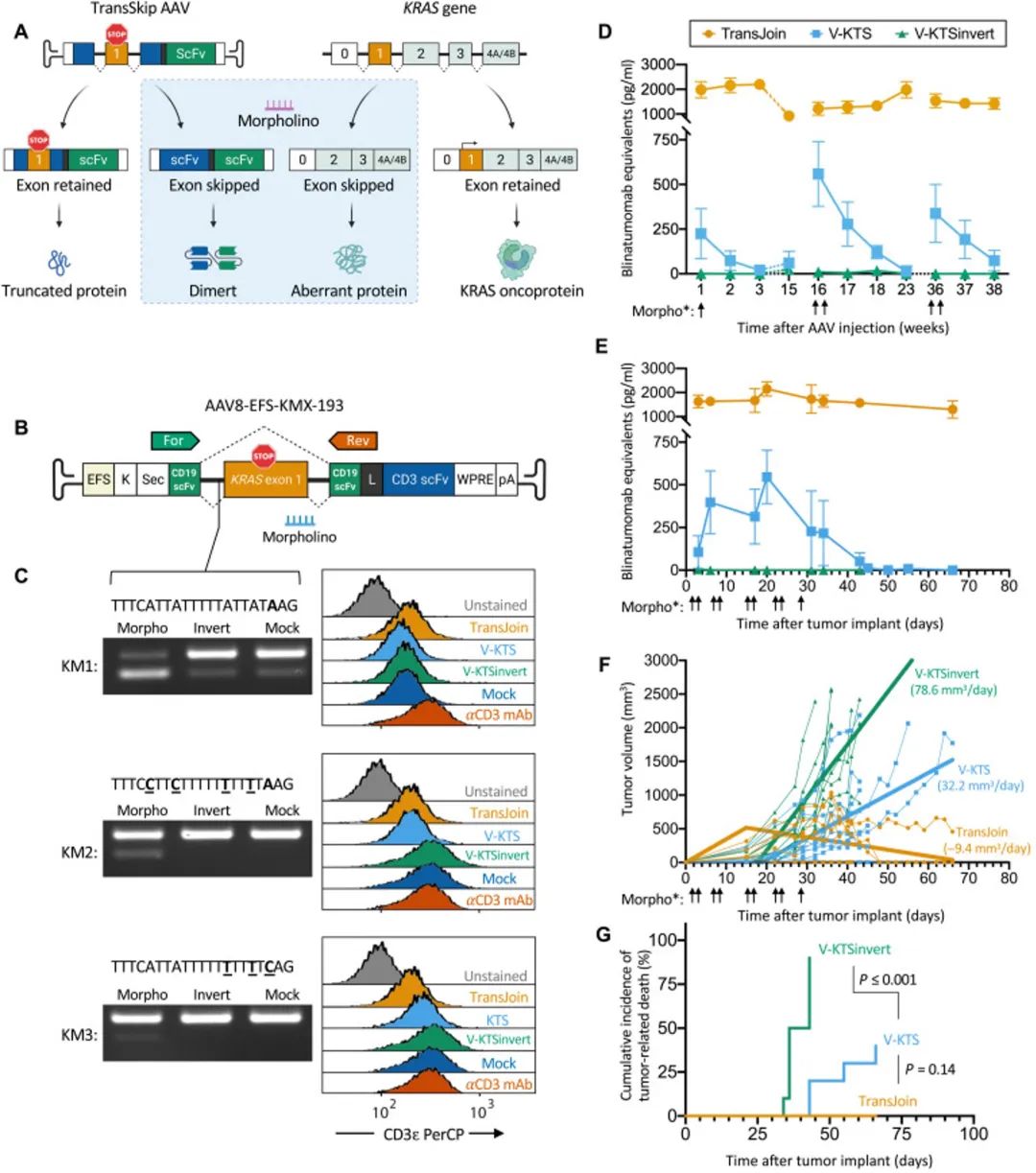
作者在证明了构建的AAVrh74-scfv(CD19×CD3),是一种有效且安全的治疗手段后,再次使用基因编辑的方法,构建了稳定且可控的载体-TransSkip。基于外显子剪切调控的原则,作者将一个有缺陷的外显子(原癌基因KRAS)逆向构建到AAV的编码序列中去,借助反义的Morpholino删除该外显子 (Morpholino(MO)全称Morpholino Anti-sense oligos。MO属于DNA/RNA类似物,相比核酸分子,MO分子结构特殊之处在于用吗啉环取代了传统核苷酸上的五碳糖环,原有的磷酸基团也发生改变,使得分子整体不带有任何电荷,因此不需要担心被降解,稳定性远高于siRNA。MO通过与不同阶段的mRNA结合,阻断目标基因的表达,包括mRNA剪切阶段和翻译阶段)。
TransSkip结构设计原理
(1)针对AAV,在scfv(CD19-CD3)中间插入修饰的KRAS minigene(取KRAS外显子1及其邻近内含子,且内部插入了多个翻译终止信号),正常情况下,表达的scfv整体结构被KRAS minigene破坏,无法形成功能性蛋白,scfv的表达受到抑制。在外源提供针对KRAS minigene剪切位点的Morpholino,该反义核酸会导致外显子的跳跃,即在scfv中去除KRAS外显子,最终促进完整scfv(CD19-CD3)的表达。
(2)针对肿瘤细胞,由于大部分KRAS存在突变,且该突变会促进肿瘤细胞的发生,上述Morpholino同样针对内源性基因的KRAS有效。Morpholino促使KRAS基因外显子1丢失,从而破坏了KRAS的转录完整性,阻止了KRAS蛋白的表达,解除了KRAS原癌基因对肿瘤细胞恶化的促进作用,可谓是一石二鸟。作者鉴定了转基因编码序列,其中一致剪接供体序列(AAG或CAG)的外显子部分恰好位于一致剪接受体序列(GG或GT)的外显子部分附近,因此插入在那里,当剪接出来时,将产生原始序列。作者将KM序列插入到潜在剪接供体/受体序列的5'位点中,以便在翻译过程中尽早破坏编码序列。
作者连续两天(第16周和第36周)给CD19 TransSkip治疗小鼠静脉注射单剂量的KTS Morpholino (Vivo-KTS)或两次静脉注射剂量的KTS Morpholino;在这些时间点,作者给另一组CD19 TransSkip处理的小鼠注射倒置Morpholino (Vivo-KTS invert)作为对照。正如预期的那样,在整个实验过程中,作者观察到CD19 TransJoin处理小鼠血清中CD19-CD的稳健表达,而在给予Vivo-KTS invert的CD19 TransSkip处理小鼠血清中没有检测到CD19-CD3的浓度(Figure 5D)。相比之下,给予Vivo-KTS的小鼠在给药后1天内产生CD19-CD3二聚体,然后在2-3周内慢慢消退到未诱导的水平。在近一年的时间里,作者每次给Vivo-KTS都能重新诱导表达。这些数据在体内证明了使用外显子跳跃来间断和重复激活AAV结构的治疗性蛋白表达的原理。作者还在5周内给予重复剂量的Vivo-KTS,证明作者可以在更长的时间内实现持续表达。
结 语
AAV作为基因治疗的载体,已经被FDA批准用于罕见的单基因疾病,像血友病和肌肉萎缩症[4]。如果临床上需要一种基因治疗的载体,同时满足安全、长效、可控,那么AAV是首选的工具病毒。本文中,仅需要单次注射TransSkip,在morpholino的诱导下,可控的、持续表达CD19-CD3二聚体,至少一年。肿瘤治疗的源头是免疫学,免疫学的研究手段是基因编辑,基因编辑技术为肿瘤治疗提供了新的手段,期待早日完成临床转化,造福患者。

公众号底部菜单栏【新功能】上线!
病毒实验帮
免费在线学习《国自然热点研究》、《数据库及软件操作教程》
一键下载《病毒使用手册》、《高分文献》
还有不定时的送新书、抽奖活动,赶紧来扫码关注一波吧
【参考文献】
1. F. Le Gall, U. Reusch, M. Little, S. M. Kipriyanov, Effect of linker sequences between the antibody variable domains on the formation, stability and biological activity
of a bispecific tandem diabody. Protein Eng. Des. Sel. 17, 357–366 (2004).
2. G. Guler-Gane, S. Kidd, S. Sridharan, T. J. Vaughan, T. C. Wilkinson, N. J. Tigue, Overcoming the refractory expression of secreted recombinant proteins in mammalian cells through modification of the signal peptide and adjacent amino acids. PLOS ONE 11, e0155340 (2016).
3. U. P. Dave, K. Cornetta, AAV joins the rank of genotoxic vectors. Mol. Ther. 29, 418–419 (2021).
4. J. R. Mendell, S. A. Al-Zaidy, L. R. Rodino-Klapac, K. Goodspeed, S. J. Gray, C. N. Kay,S. L. Boye, S. E. Boye, L. A. George, S. Salabarria, M. Corti, B. J. Byrne, J. P. Tremblay, Current clinical applications of in vivo gene therapy with AAVs. Mol. Ther. 29, 464–488 (2021).
